年来研究发现,线虫的睡眠主要由RIS神经元通过释放FLP-11 RFamide神经肽驱动。FLP-11通过抑制胆碱能神经元活性诱导睡眠,但其作用受体长期未被鉴定,且睡眠的分子开关机制仍不明确。此外,睡眠的持续时间如何被精准调控,以及睡眠如何与其他生理功能(如能量代谢、氧化应激保护)关联,仍是亟待解决的难题。例如,在哺乳动物中,睡眠不足与代谢紊乱、免疫功能下降密切相关,而线虫研究中发现的保护性基因(如热休克蛋白HSP-12.6)是否通过睡眠调控网络发挥作用,尚需进一步探索。
基于上述问题,来自德国德累斯顿工业大学与比利时鲁汶大学的科研团队在Cell Press细胞出版社旗下期刊Current Biology上在线发表了一篇题为“The neuropeptide FLP-11 induces and self-inhibits sleep through the receptor DMSR-1 in Caenorhabiditis elegans”的研究性论文,首次揭示了DMSR-1受体在睡眠诱导与限制中的双重功能。

睡眠作为生命活动的核心生理过程,其调控机制一直是神经科学领域的研究热点。从人类到低等生物,睡眠行为在进化上高度保守,暗示其背后存在基础的分子调控网络。在哺乳动物中,睡眠由复杂的神经网络调控,涉及下丘脑、脑干等多个脑区的协同作用,并受多种神经递质(如腺苷、谷氨酸)和神经肽(如食欲素、褪黑素)的动态调节。
然而,睡眠的分子机制及其如何精确控制睡眠-觉醒周期仍有许多未解之谜。例如,睡眠的启动信号如何整合环境与生理需求?睡眠持续时间如何根据代谢状态动态调整?这些问题在哺乳动物中因神经系统的复杂性而难以解析。因此,科学家将目光转向模式生物线虫(Caenorhabditis elegans)。线虫仅拥有302个神经元,且神经元间连接图谱已被完全解析,其神经系统虽简单却高度保守,成为揭示睡眠本质的理想模型。自20世纪70年代起,线虫在行为遗传学、衰老研究和神经环路解析中屡建奇功,例如通过线虫研究发现的凋亡基因ced-3和ced-4为哺乳动物细胞凋亡机制奠定了基础。在睡眠领域,线虫的休眠行为(如发育滞育期和应激诱导的睡眠)与哺乳动物睡眠在分子机制上存在显著相似性,为跨物种机制研究提供了突破口。
研究者通过构建dmsr-1(qn45)和dmsr-1(sy1522)两种突变体,发现线虫在L1滞育期的睡眠时间减少约50%。睡眠结构分析显示,突变体的睡眠片段频率和持续时间均显著降低。钙成像实验进一步表明,尽管RIS神经元的激活频率未发生改变,但其钙信号基线水平和睡眠期间的峰值强度显著升高。这一现象提示,DMSR-1可能通过抑制RIS的过度激活来维持睡眠稳态。
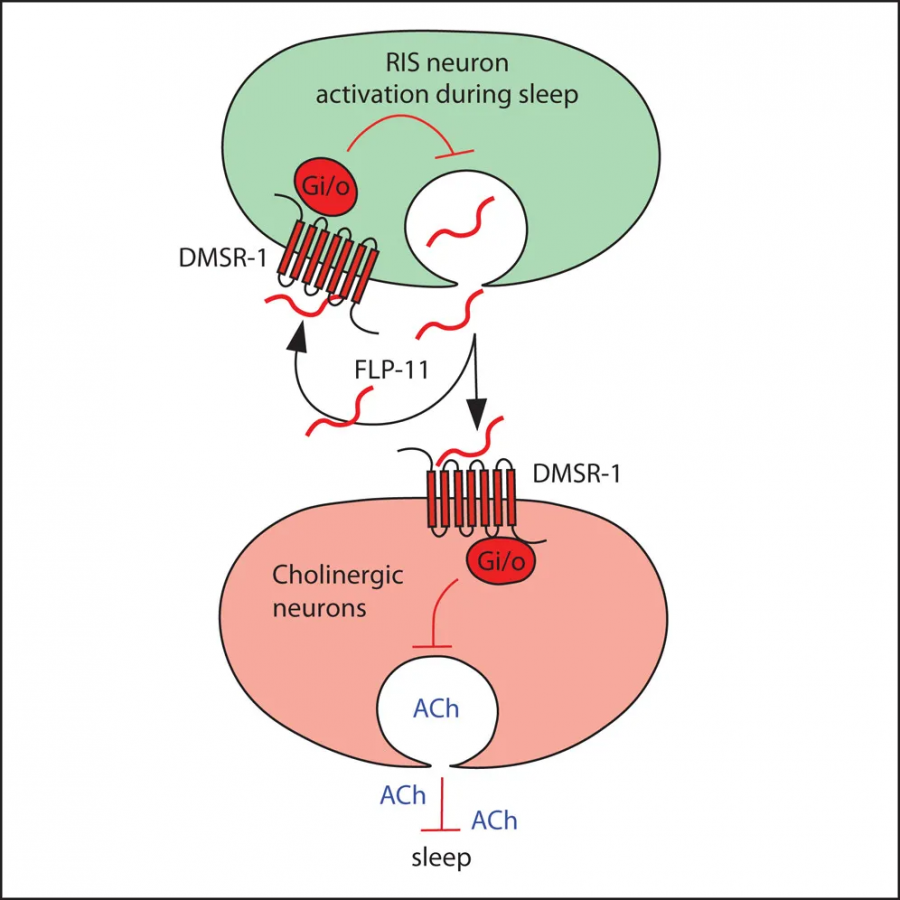
为明确DMSR-1是否介导FLP-11的睡眠调控功能,研究者通过基因互作实验发现,flp-11(tm2706)突变体的睡眠缺陷与dmsr-1突变表型部分重叠,且双突变体表型与flp-11单突变体一致。通过热激诱导FLP-11过表达,野生型线虫睡眠时间增加近3倍,而该效应在dmsr-1突变体中完全消失。光遗传学激活RIS神经元后,野生型线虫运动速度显著降低,但dmsr-1突变体未表现类似抑制,证实DMSR-1位于RIS下游。
电生理实验显示,DMSR-1被FLP-11激活后可显著增强GIRK钾通道电流,而该效应被百日咳毒素(PTX)完全阻断,证实其通过Gi/o蛋白偶联发挥抑制作用。细胞特异性敲除实验进一步揭示了DMSR-1的双重角色:在胆碱能神经元中敲除dmsr-1导致睡眠时间减少90%,而在GABA能神经元中敲除则使睡眠时间翻倍。机制上,FLP-11通过DMSR-1抑制胆碱能神经元的乙酰胆碱释放,而药物干预(如低浓度艾氏剂)抑制乙酰胆碱降解可重现睡眠缺陷。
单细胞测序数据表明,RIS神经元自身表达DMSR-1。通过构建RIS特异性敲除模型,研究者发现dmsr-1缺失导致RIS钙信号峰值强度增加40%,睡眠片段持续时间延长。值得注意的是,尽管睡眠时间增加提升了保护性基因HSP-12.6的表达,但过度睡眠可能因能量消耗增加而降低适应性。这一自反馈机制揭示了睡眠诱导与终止的精密平衡:FLP-11-DMSR-1信号在激活睡眠的同时,通过抑制RIS自身活性防止睡眠过度延长。
该研究不仅揭示了睡眠的双向调控机制,还为理解哺乳动物睡眠障碍提供了新视角。通讯作者Henrik Bringmann教授指出,DMSR-1与哺乳动物GPR139的进化同源性提示RFamide神经肽-GPCR信号可能是跨物种保守的睡眠调控模块。未来研究可探索DMSR-1在哺乳动物睡眠-觉醒周期中的作用,例如通过构建GPR139条件敲除小鼠模型,验证其在慢波睡眠调控中的功能。
此外,基于自反馈通路的药物开发潜力巨大:靶向DMSR-1激动剂或拮抗剂可能成为治疗失眠或嗜睡症的新策略,而结合神经肽释放的动态监测技术(如光纤记录)可优化给药时机。睡眠与衰老、代谢的交互机制亦是重要方向。例如,线虫中发现的HSP-12.6是否通过延长睡眠增强抗衰老能力?睡眠调控网络如何与胰岛素信号、线粒体功能等长寿通路交叉对话?这些问题将推动抗衰老研究从单一基因干预转向系统生理学整合。技术层面,新型基因编辑工具(如碱基编辑)和单细胞多组学技术的应用,有望在更高时空分辨率下解析睡眠调控网络的动态变化。
总之,这项研究为揭开睡眠之谜提供了关键拼图,其科学价值不仅在于解释线虫的微观机制,更在于为人类健康开辟了从基础研究到临床转化的广阔路径。
相关论文信息
相关论文刊载于CellPress细胞出版社,旗下期刊Current Biology
▌论文标题:
The neuropeptide FLP-11 induces and self-inhibits sleep through the receptor DMSR-1 in Caenorhabiditis elegans ▌论文网址: https://www.sciencedirect.com/science/article/pii/S0960982225003550 ▌DOI: https://doi.org/10.1016/j.cub.2025.03.039
原标题:睡眠调控新突破:神经肽自反馈机制揭秘线虫睡眠开关 | Cell Press论文速递
本文转载于微信公众号:CellPress细胞科学(ID:CellPressChina),转载引用请注明原出处