
减肥路上的心酸,恐怕只有真正经历过的人才能体会。每次减肥都在想,为什么长肉这么容易,减肥这么痛苦!如果睡一觉就能瘦下来就好了。
这个曾被视为痴人说梦的幻想,竟被中南大学湘雅医院团队揭开了现实面纱!

最近,一项发表在Cell Research的研究表明,新发现的睡眠激素 Raptin,正是人体自带的食欲抑制剂,在深度睡眠中大量分泌,既抑制下丘脑的饥饿信号,又能延缓胃排空速度。说不定,未来我们真的可以躺着减肥。
01 “Raptin”:睡眠中诞生的体重守护者
Raptin的发现始于对睡眠碎片化小鼠的研究。当科学家们剥夺小鼠的连续睡眠时,这些小鼠不仅体重明显增加,食量也显著上升,但能量消耗却没有变化——这与人类熬夜后暴饮暴食的现象惊人相似。
为了寻找背后元凶,研究者们对小鼠下丘脑(大脑调节食欲和睡眠的核心区域)进行了蛋白质组学分析。结果,一个名为Reticulocalbin-2(RCN2)的蛋白质引起了注意:它在睡眠不足的小鼠下丘脑中含量显著降低。
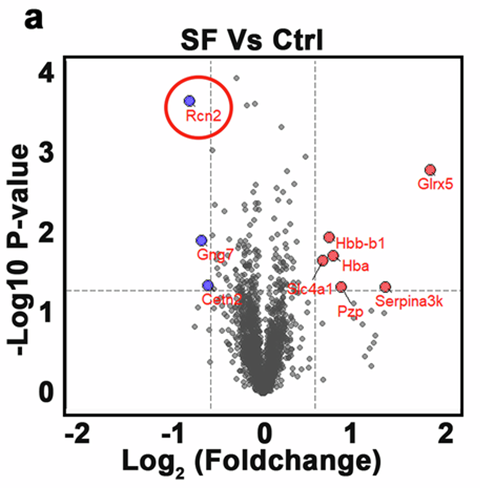
与对照相相比,碎片化睡眠小鼠下丘脑中发现的失调因子,红色圆圈表示Rcn2。(Source:Cell research,2025)
更深入的研究揭示了RCN2的“变身”秘密。科学家发现,下丘脑中特定的神经元(主要集中在一个叫室旁核的区域)会在睡眠期间高水平表达RCN2。这个全长蛋白质并非直接发挥作用,而是会被一种名为激肽释放酶(如KLK1、KLK4)的蛋白酶精准切割,释放出一个分子量较小的活性片段。这个被激活的片段,就是Raptin。(取自rapid与leptin的融合,寓意其快速抑制食欲的特性)。
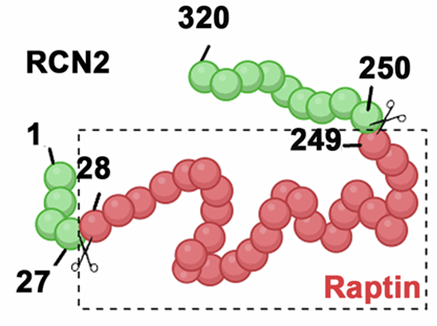
RCN2裂解成Raptin的示图。(Source:Cell research,2025)
Raptin的释放严格遵循着昼夜节律的指挥棒。无论是小鼠还是人类,血液中的Raptin水平在睡眠期达到峰值,而在清醒活动期降至低谷。这种节律并非单纯依赖环境光暗变化,因为即使在持续黑暗的环境中,Raptin的分泌依然保持其固有的睡眠高峰模式。
然而,当睡眠被强制打断(睡眠碎片化)时,这种精妙的节律就被打乱,Raptin的分泌量大幅减少。
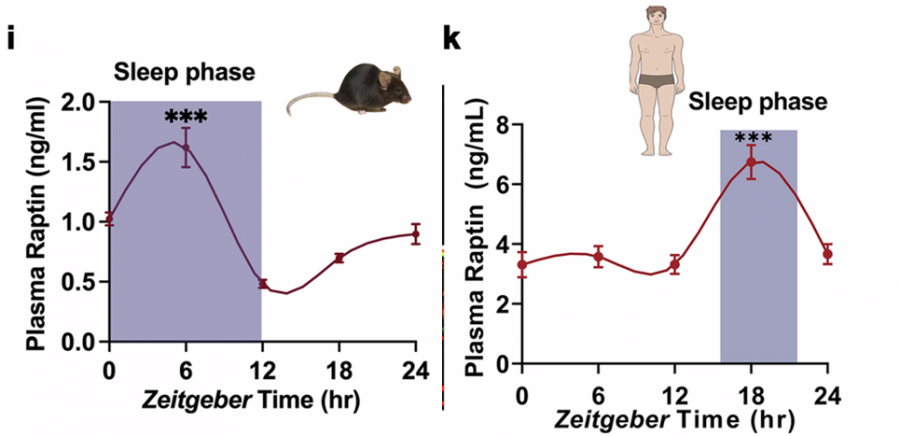
雄性小鼠(图i)和人类(图k)血浆的Raptin水平,紫色区域表示睡眠阶段。(Source:Cell research,2025)
那么,是谁在幕后指挥着Raptin的昼夜之舞?答案指向大脑的生物钟核心——视交叉上核(SCN)。
SCN如同人体内的“中央时钟”,其中的一类特殊神经元——加压素(AVP)阳性神经元——扮演着关键角色。这条调控通路中,SCN的AVP神经元发出信号,直接调控下丘脑室旁核(PVN)中生产RCN2的神经元的活动。
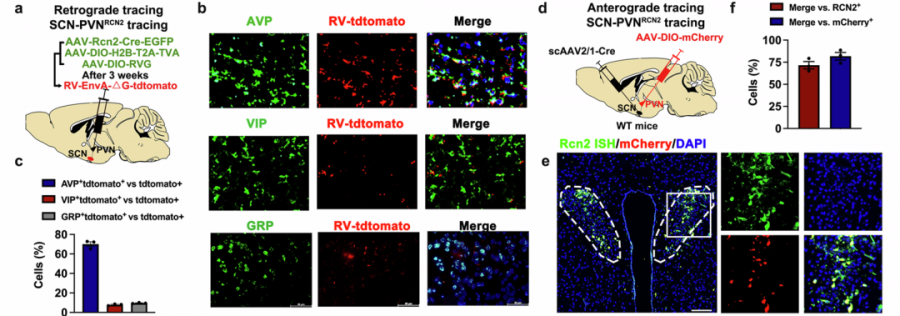
SCN控制调控RCN2神经元机制。(Source:Cell research,2025)
当SCN的AVP神经元被激活时,PVN的RCN2神经元变得活跃,Raptin的分泌随之增加;反之,抑制SCN的AVP神经元则导致PVN神经元活动减弱,Raptin释放减少。
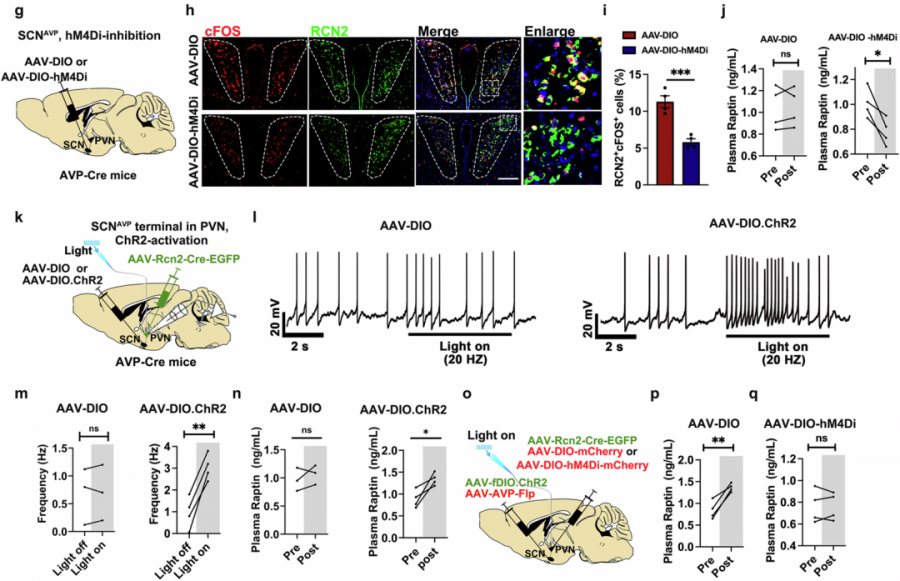
Raptin的神经调节机制。(Source:Cell research,2025)
这条从“中央时钟”(SCN-AVP神经元)到“激素工厂”(PVN-RCN2神经元)再到“代谢信使”(Raptin)的通路,构成了睡眠调控食欲的核心神经内分泌轴。Raptin在睡眠中悄然升起,像一道无形的屏障,抑制着我们夜间不该出现的食欲冲动。
当睡眠不足干扰了SCN的正常节律输出,或是直接损害了这条通路的功能时,Raptin的分泌就会受阻,那道“食欲刹车”失灵了,体重增加的闸门也就此打开。
02 Raptin与肥胖:被偷走的食欲控制
研究发现,连续两个月被剥夺深度睡眠的小鼠,下丘脑中RCN2蛋白表达量骤减,血浆Raptin水平较正常小鼠降低。这些小鼠不仅食量暴增,体重也像脱缰野马般增长。
当研究者通过基因技术在小鼠PVN区过表达Raptin时,奇迹发生了——尽管仍处于睡眠剥夺环境,小鼠的食欲和体重却恢复正常水平。更神奇的是,直接向大脑脑室持续输注Raptin蛋白(40 ng/h/g体重),仅四周就成功逆转了肥胖进程。也就是说,Raptin缺失就是睡眠不足导致肥胖的关键元凶!
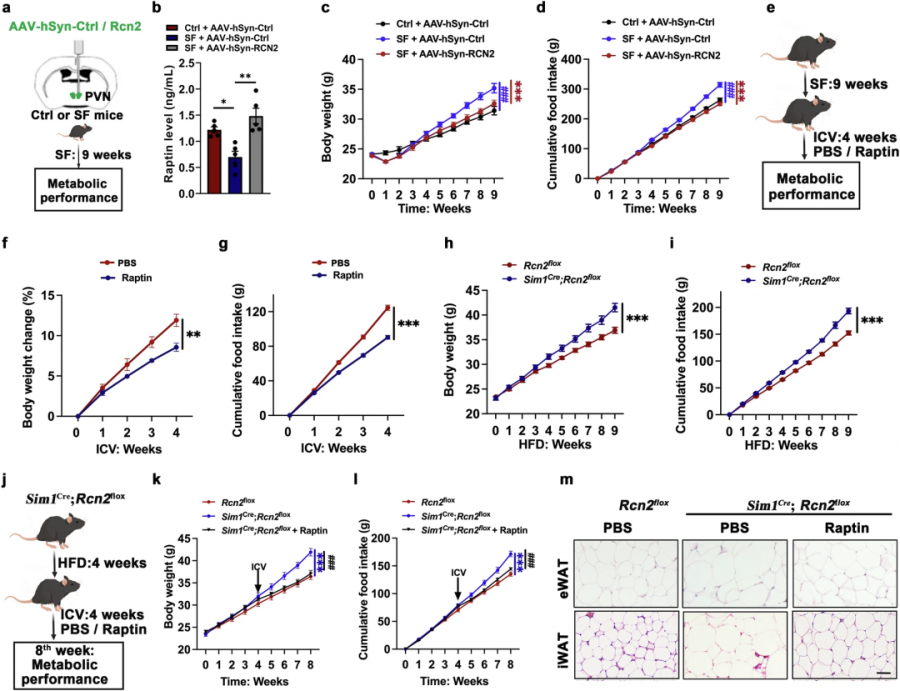
下丘脑来源的Raptin抑制食物摄入量并预防肥胖。(Source:Cell research,2025
Raptin的神奇功效究竟从何而来?
Raptin通过与代谢型谷氨酸受体3(GRM3)结合发挥作用。令人惊讶的是,这把钥匙能同时打开大脑和胃肠道的两把锁——在下丘脑PVN区,Raptin激活表达GRM3的神经元,直接抑制进食欲望;在胃部肌层,它作用于含一氧化氮合酶(NOS1)的神经元,显著延缓胃排空速度。
而同时破坏两个靶点时,小鼠的肥胖程度呈指数级增长,即使补充外源Raptin也毫无效果。这解释了为何单纯抑制大脑饥饿感的效果有限,只有当大脑的"食欲开关"与胃肠的"饱腹时钟"同步调控时,才能真正遏制暴食冲动。
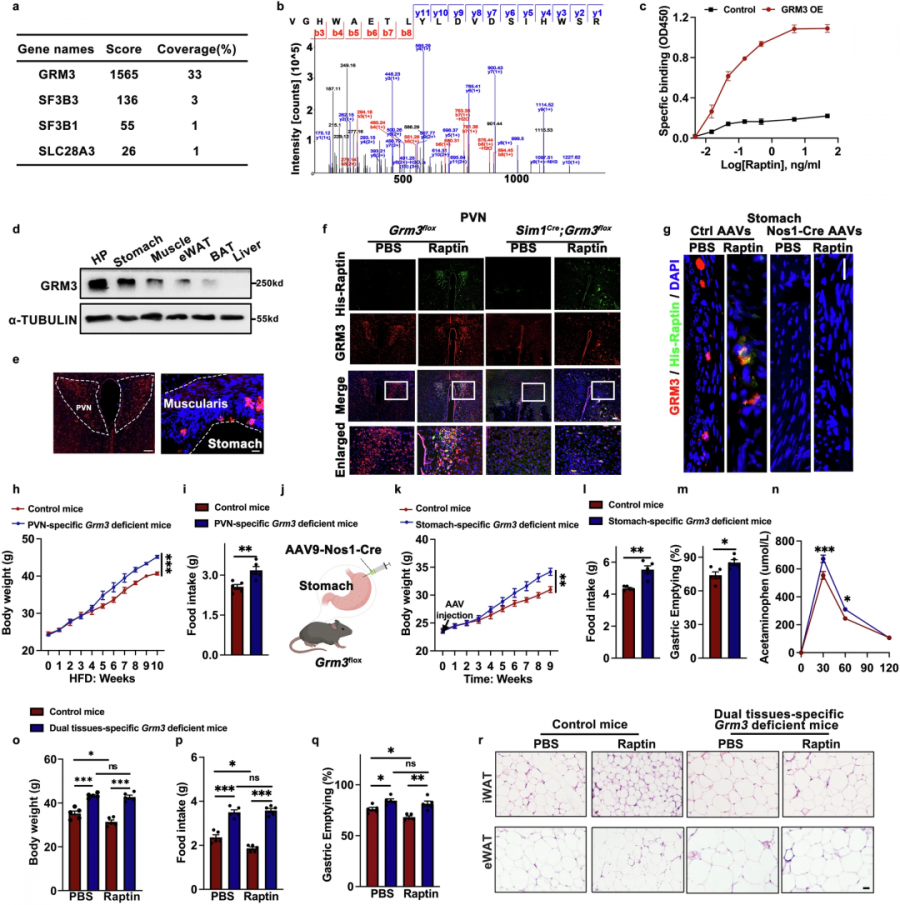
Raptin与PVN、胃神经元中的GRM3结合以抑制食物摄入(Source:Cell research,2025)
当Raptin结合GRM3受体后,会启动一条独特的PI3K-AKT信号通路。这条新通路犹如为神经元开启快充模式:磷酸化蛋白质组学分析显示,Raptin能促进驱动蛋白(KHC)与线粒体的结合,加速细胞发电机向神经元活动区域运输。
活细胞成像技术捕捉到震撼画面:经Raptin处理的神经元内,线粒体ATP水平显著升高,为神经信号传递提供充足能量。当研究者敲除KHC蛋白后,即使补充Raptin也无法激活神经元,小鼠依然暴饮暴食。也即,食欲调控不仅关乎信号传递,更依赖于细胞能量供给系统的精确调度。
在262例人体研究中,肥胖组(BMI>28)的睡眠效率比正常组低,血浆Raptin水平也显著降低。更耐人寻味的是,在肥胖人群中,Raptin浓度与睡眠效率呈强烈正相关,与BMI值呈负相关。
当研究者对15例肥胖合并失眠患者进行为期三个月的睡眠限制疗法(SRT)时,干预组睡眠效率、Raptin水平显著,而日均热量摄入和体重呈现下降趋势。这些数据证实:改善睡眠质量→提升Raptin→抑制食欲→减轻肥胖,构成一条清晰的因果链条。
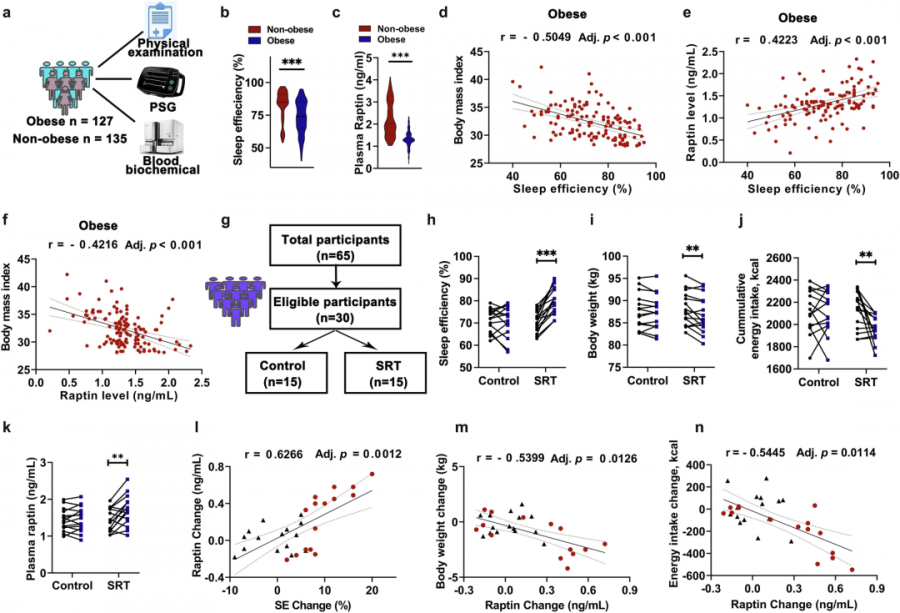
Raptin与睡眠不足诱导的人类肥胖有关(Source:Cell research,2025)
在基因方面,研究者在对肥胖者基因筛查时,发现一个家族携带RCN2基因无义突变(c.469C>T)。该突变导致RCN2蛋白在157位精氨酸处提前终止,就像一本残缺的食谱,无法产出完整的Raptin。所有携带此突变的家族成员均患有夜食症(NES),表现为夜间清醒状态下不可控的暴食行为。
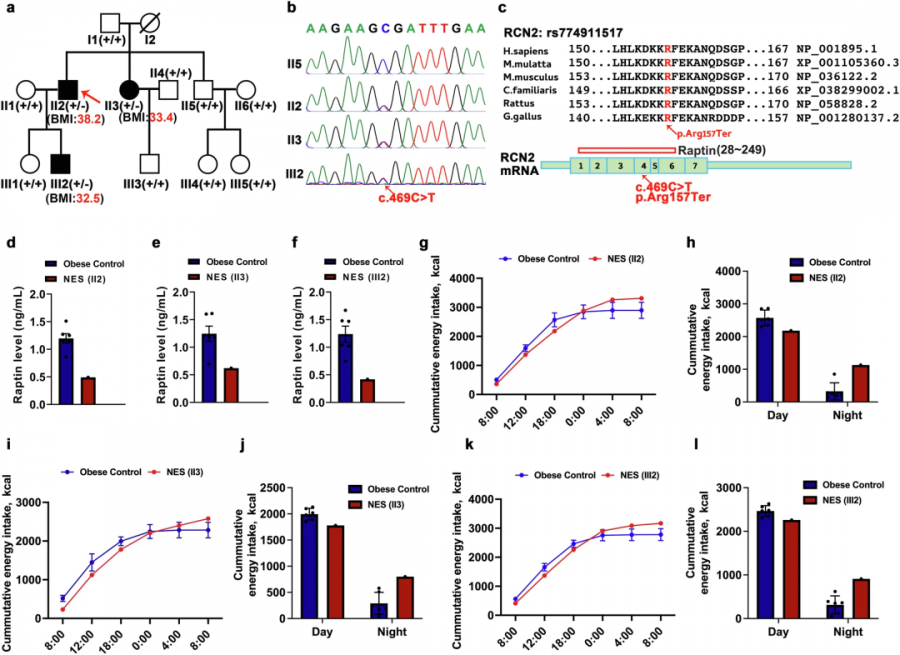
RCN2无义突变导致夜食症(Source:Cell research,2025)
03 肥胖治疗的新曙光:睡个好觉很关键
当GLP-1受体激动剂以“减肥神药”之名席卷全球时,医药市场正经历一场空前狂欢。诺和诺德的司美格鲁肽(Wegovy)创下年销售额293亿美元的奇迹,礼来的替尔泊肽更以24%的减重效果刷新纪录,国内药企也争相布局GLP-1靶点,仿佛握住了一把通往万亿市场的金钥匙。
而这项研究为肥胖治疗提供一个新思路:睡眠不足导致肥胖不仅是因为醒着的时间变长,更关键的是失去了睡眠中产生的食欲抑制剂。Raptin通过双闸门机制同步调控大脑与胃肠,抑制饥饿信号,延缓胃排空速度。若靶向此通路的药物研发成功,人类或许将首次实现“通过模拟优质睡眠”来对抗肥胖。
然而,新药研发道阻且长。在Raptin激动剂问世前,研究已为普通人指明一条零成本的代谢守护之路:重拾被现代生活剥夺的睡眠权利。
每一次深夜刷新的屏幕、每一杯强撑精神的咖啡,都在窃取下丘脑中悄然工作的Raptin分子,它们本是进化赋予的“内置减重系统”,却在灯火通明的时代被迫集体沉默。
关掉光源,闭上眼睛,来一场睡眠中的深度修复,这或许是人类面对肥胖浪潮时,最古老也最前瞻的智慧。毕竟,最有效的减肥处方,或许早已写在昼夜交替的古老法则中,免费却也无价。
ref:
Xie, L. Q., Hu, B., Lu, R. B., Cheng, Y. L., Chen, X., Wen, J., Xiao, Y., An, Y. Z., Peng, N., Dai, Y., Xie, G., Guo, Q., Peng, H., & Luo, X. H. (2025). Raptin, a sleep-induced hypothalamic hormone, suppresses appetite and obesity. Cell research, 35(3), 165–185. https://doi.org/10.1038/s41422-025-01078-8
原标题:Cell Research重磅研究:睡眠激素Raptin是人体自带的减肥开关,躺着也能减肥!
本文转载于微信公众号:PengzuLab(ID:gh_aa8a2dd42126),转载引用请注明原出处