
有没有人试过——熬夜到凌晨两三点,第二天照常起床上班?那种状态,就像大脑被迫开启了“省电模式”,无论喝多少冰美式,脑子依旧昏昏沉沉。更可怕的是,如果这种熬夜成为常态,记忆力会开始掉线,免疫力逐渐塌方,甚至生命都可能被透支。大家都知道“睡眠很重要”,可科学家真正困惑的问题是:人类为什么非得睡觉?为什么不能像手机一样,只要插上电源就能无限运转?
最近,来自英国牛津大学的团队在Nature上发表了一项研究[1],给出了一个颇具颠覆性的线索:睡眠压力可能源自大脑特定神经元中线粒体的ATP过剩。换句话说,睡眠或许不仅是大脑的“放假时间”,更可能是身体能量工厂维持正常运转的“必修课”。

线粒体:不只是能量工厂,更是睡眠“开关”
线粒体,那个在生物课本上学过的“细胞能量工厂”,通过呼吸链源源不断地产生ATP,为细胞提供能量。那么,它和睡眠到底有什么关系呢?

这一切要从一类特殊的神经元说起。
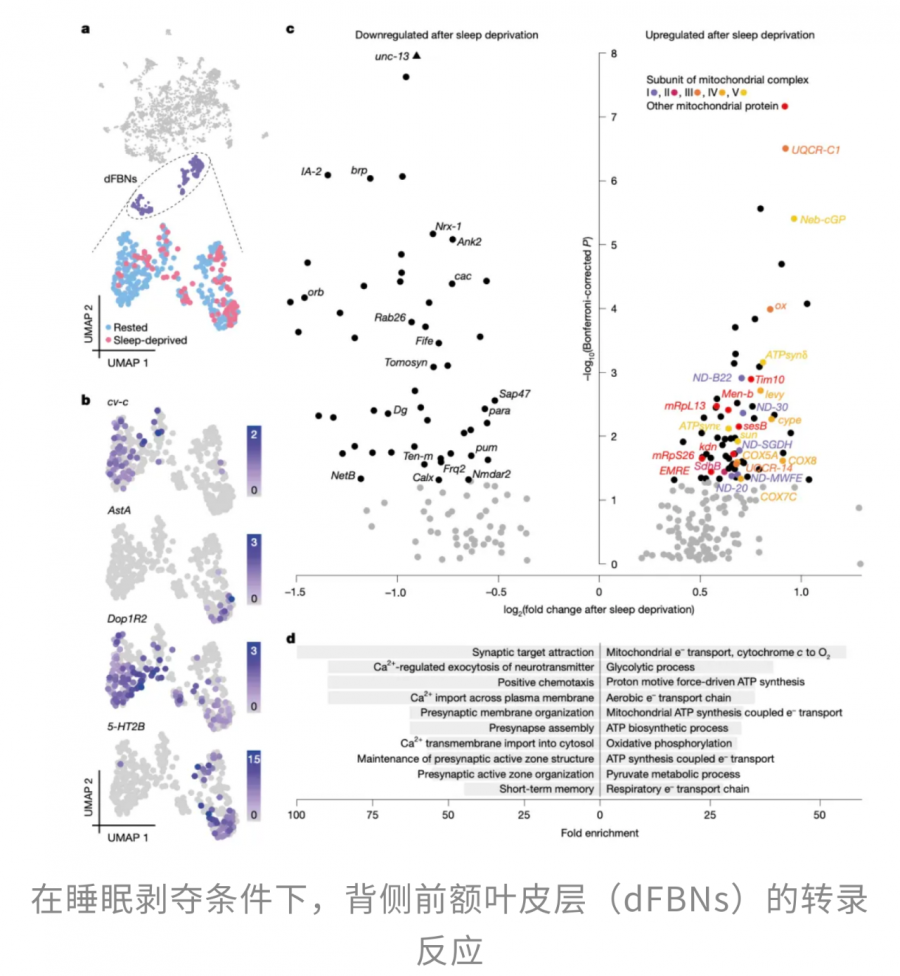
在果蝇大脑中,有一群被称为dFBNs的“促睡神经元”,位于背侧扇形体。
但问题是:为什么能量工厂越忙碌,我们反而越困?
答案就在于“电子泄漏”。熬夜清醒时,大脑和身体被迫持续运作,即便夜晚通常不进食,机体仍会通过分解肝糖原、动员脂肪等方式,维持清醒所需的代谢活动。大多数神经元能够顺利利用这些能量,但dFBNs却有些特殊:它们是“睡眠期才活跃”的神经元,熬夜时电活动低、能量消耗有限。
结果就是,ATP像仓库里的货物一样在dFBNs内堆积得越来越满。供给大、消耗小,多余的电子无处释放,只能溢出,与氧分子结合生成超氧自由基等活性氧(ROS),进一步氧化细胞内的脂质、蛋白质和 DNA。正因为如此,dFBNs成了大脑天然的睡眠压力传感器:它们通过感知线粒体内堆积的电子和随之产生的氧化压力,向整个神经网络发出信号——“该睡觉了”。
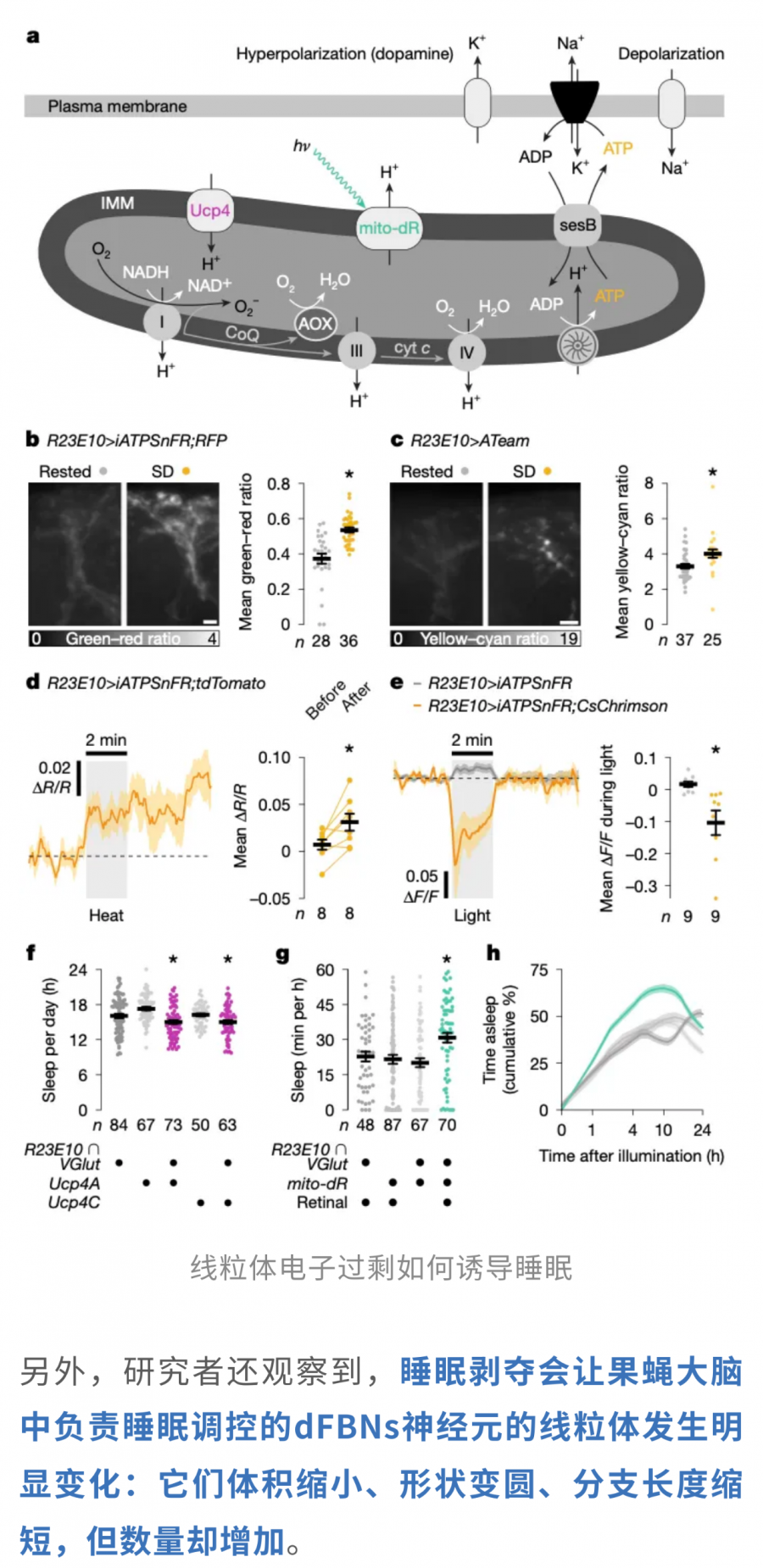
这是一种典型的线粒体分裂现象。通常,这种分裂发生在线粒体受损或需要重组清除之前,意味着神经元正处于一种动态应激状态。
然而,分裂只是整个过程的开端。随着睡眠剥夺的持续,线粒体与内质网的接触点增多,为修复受损脂质提供通道,同时受损的线粒体片段也会被送去“自噬车间”清理,保持整个网络的整洁与功能正常。由此可见,睡眠剥夺触发了一系列线粒体的动态响应——从分裂到接触增强,再到受损片段清除,形成了一个完整的适应性循环。
当恢复睡眠后,dFBNs的线粒体开始重建,融合增强,体积、形态和分支长度不仅恢复到基线水平,甚至显著超过睡眠剥夺前的状态。
更进一步的实验表明,如果人工干预这些神经元的线粒体动力学,也可以双向调控睡眠行为:促进线粒体融合会提升神经元兴奋性,使睡眠时间延长;而促进线粒体分裂则会降低神经元兴奋性,从而减少睡眠时长。
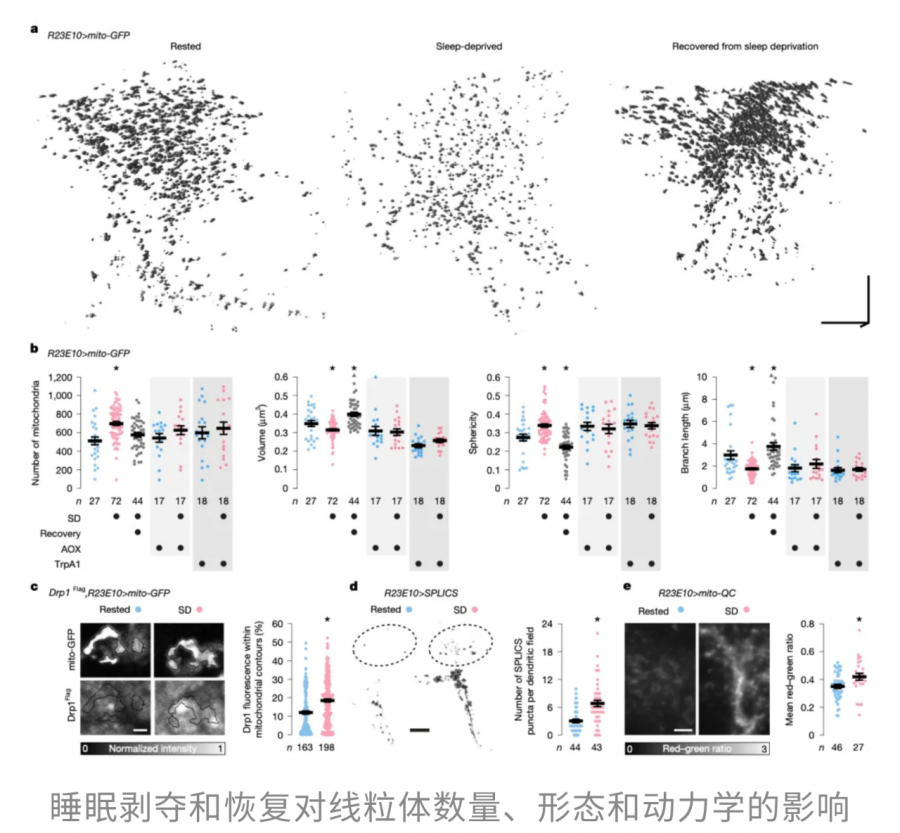
总的来说,这项研究揭示了线粒体分裂和融合的动态变化对睡眠需求具有直接调控作用。线粒体通过改变自身的形态和功能,进而影响dFBNs的兴奋性:分裂让神经元活动下降,降低睡眠需求;融合则提升神经元活动,增加睡眠需求。这一机制清楚地说明,线粒体不仅是细胞能量工厂,更是调控睡眠行为的重要枢纽,其形态和功能的微小变化就能决定神经元的活动水平,从而调节整个睡眠系统的平衡。
当氧化压力“攻陷”全脑
长期熬夜会把线粒体推上“满负荷运转”的快车道:电子溢出增加,ROS悄悄攒多了。当这种氧化压力不再局限于个别神经元,而是蔓延到更大范围时,影响就不只是神经元的放电状态那么简单了——细胞膜的化学成分和抗氧化防线也会被牵连进来,为更深层的损伤埋下伏笔。
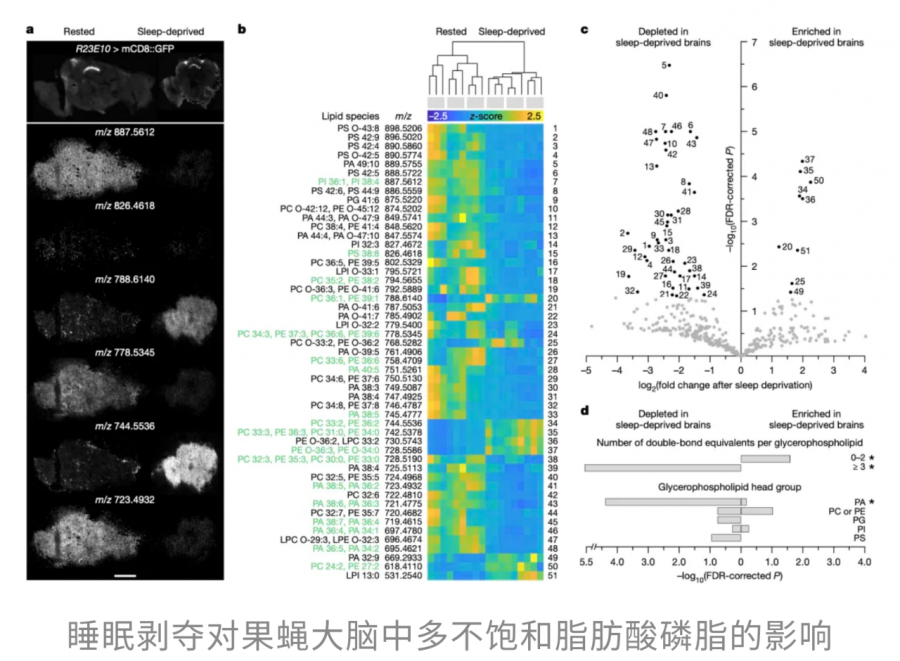
同个研究团队发表于Nature的另一项研究[2]发现,当果蝇被迫熬夜时,它们大脑里的甘油磷脂种类变得单一,原本修长的脂肪链也被削短了。这样的变化让细胞膜失去了应有的韧性,变得僵硬脆弱,抵抗氧化损伤的能力也明显下降,最终让整个大脑陷入一种普遍的氧化压力状态。

也就是说,大脑在经历熬夜后,真的在分子层面“换了一身行头”。
那这身“新装”有什么特点呢?如果说休息后的大脑膜脂是“丝滑顺畅”的高级面料,熬夜后的膜脂就是缩水、发硬的“廉价版”。

这其实揭示了一个关键机制:熬夜会让大脑失去最脆弱、但也是最宝贵的PUFAs。这正是氧化压力的典型结果。与此同时,PA的减少意味着膜修复和再生的原料不足,也削弱了线粒体的融合信号。这就与研究[1]形成呼应,说明氧化损伤不仅改变了膜的化学组成,还破坏了线粒体的动态平衡,最终推高对睡眠的生理需求。
大脑“宕机”前,磷酸化密码先乱了
说了这么多熬大夜带来的危害,从线粒体被拖垮,到大脑膜脂被氧化,其实都还只是“前奏”。真正让人不寒而栗的,是长期熬大夜、缺觉会把大脑一步步推向一个不可逆的生理临界点。一旦跨过这条线,损伤就不再只是暂时性的疲劳或功能下降,而是与死亡风险直接挂钩。
近期,来自哈尔滨工业大学的研究团队发表于Nature子刊Cell Discovery的一项研究[3]表明,进入一个“不可逆转点”(PONE)时,会伴随脑内磷酸化蛋白组的严重失衡;这种磷酸化紊乱与死亡风险和睡眠调控紧密相关,而短时恢复睡眠可以延缓PONE并恢复磷酸化稳态,表明睡眠在维持脑磷酸化稳态中起关键保护作用。
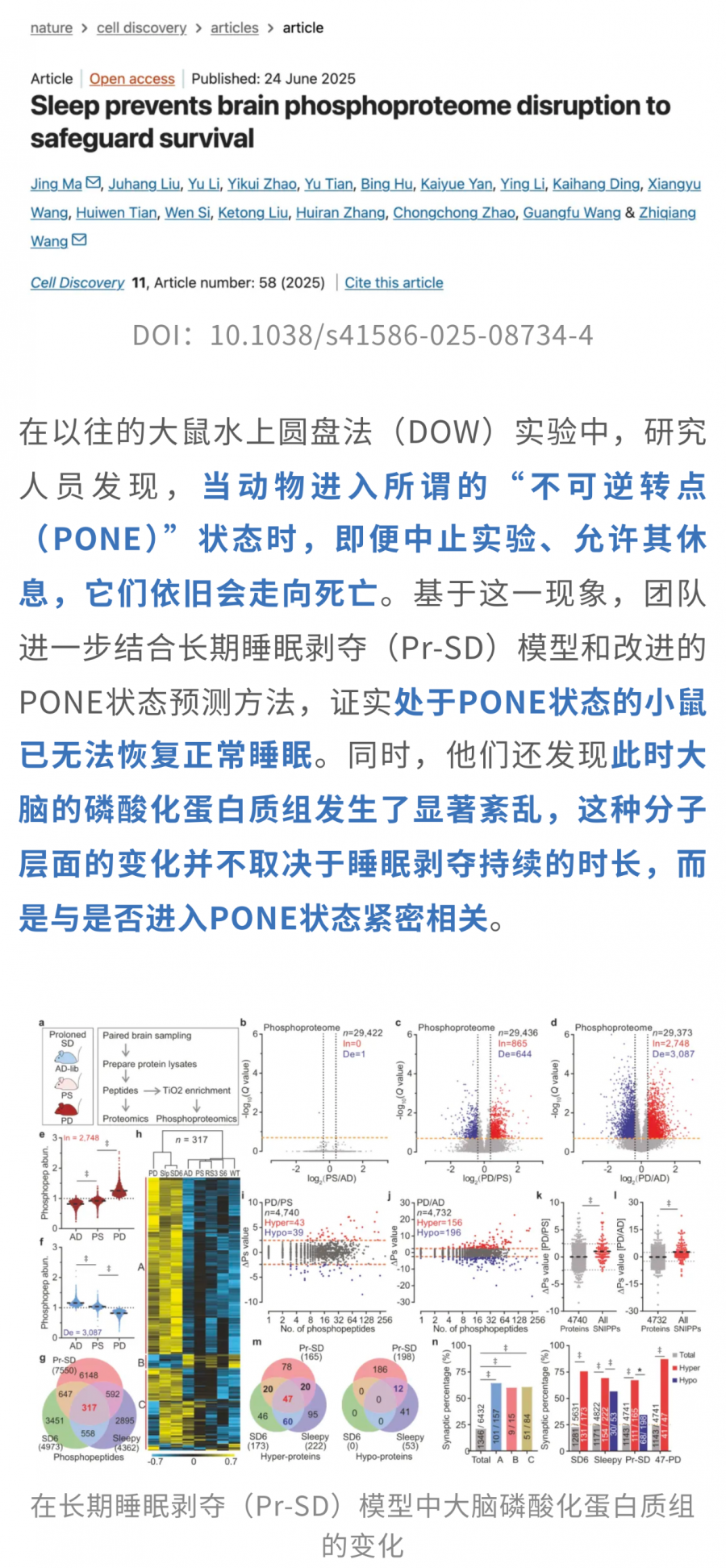
更深入的分析显示,这些发生紊乱的磷酸化蛋白绝大多数都与突触功能密切相关,包括谷氨酸能突触、内吞作用、突触囊泡释放以及长时程增强(LTP)等关键通路。
事实上,大脑中的激酶与磷酸酶就像神经网络的“调节阀”,一旦功能失衡,就会打破磷酸化的精密平衡,推动小鼠进入PONE状态,同时伴随明显的睡眠异常。
既然长期睡眠剥夺会破坏磷酸化平衡,那么补充睡眠能否逆转这一过程呢?

更进一步,当恢复性睡眠与补偿性磷酸酶表达相结合时,能够有效抵消过度激酶活性对 PONE状态发展的不良影响,使神经网络重新回到平衡状态。
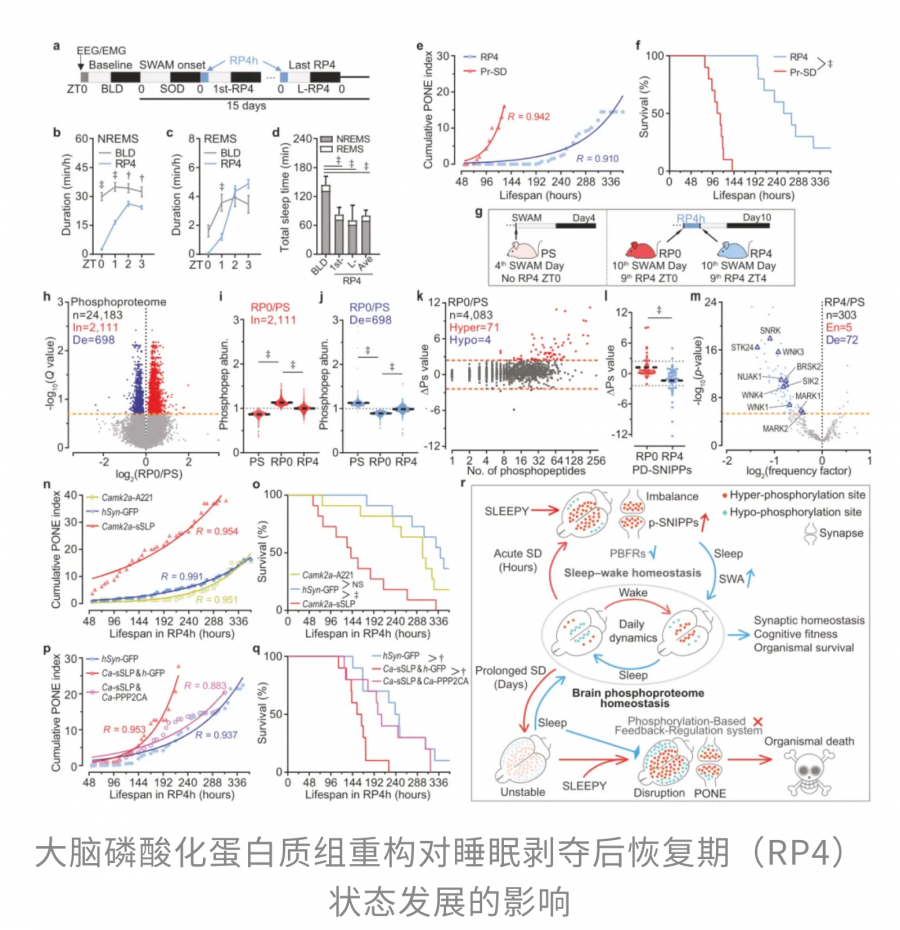
总的来说,这项研究通过建立小鼠睡眠剥夺模型,揭示了睡眠对于维持大脑磷酸化蛋白质组稳态的重要性。睡眠的缺失会打破这一精密平衡,导致 PONE 状态和最终死亡,而恢复性睡眠与补偿性磷酸酶表达则可以有效延缓这一过程,为理解睡眠与神经功能稳态之间的关系提供了关键证据。
看完这些关于熬夜的研究,是不是感觉脊背发凉,仿佛听到了身体在深夜里发出的抗议声?不睡觉可不是闹着玩的,它真的会把我们推向各种问题的边缘。不过,别担心,要是晚上辗转反侧,难以入眠,不妨试试这些小妙招:把卧室布置得安静又黑暗,温度调得凉爽些,再配上柔软舒适的床上用品,让自己彻底放松下来。睡前别碰那些电子设备,屏幕的光亮只会让大脑更加兴奋。试试泡个热水澡,读一本有趣的书,或者听听轻音乐,让这些温柔的活动带走一天的疲惫和紧张。说不定,用不了多久,就能在梦乡里畅游了~
仍需指出的是,上述研究主要基于果蝇和小鼠模型,可能无法完全反映人类睡眠调节的复杂性。
参考资料:
[1]Sarnataro R, Velasco CD, Monaco N, Kempf A, Miesenböck G. Mitochondrial origins of the pressure to sleep. Nature. 2025 Jul 16. doi: 10.1038/s41586-025-09261-y. Epub ahead of print. PMID: 40670797.
[2]Rorsman HO, Müller MA, Liu PZ, Sanchez LG, Kempf A, Gerbig S, Spengler B, Miesenböck G. Sleep pressure accumulates in a voltage-gated lipid peroxidation memory. Nature. 2025 May;641(8061):232-239. doi: 10.1038/s41586-025-08734-4. Epub 2025 Mar 19. PMID: 40108451; PMCID: PMC12043502.
[3]Ma J, Liu J, Li Y, Zhao Y, Tian Y, Hu B, Yan K, Li Y, Ding K, Wang X, Tian H, Si W, Liu K, Zhang H, Zhao C, Wang G, Wang Z. Sleep prevents brain phosphoproteome disruption to safeguard survival. Cell Discov. 2025 Jun 24;11(1):58. doi: 10.1038/s41421-025-00809-w. PMID: 40555714; PMCID: PMC12187926.
原标题:长期熬大夜会怎么样?Nature和子刊:线粒体疯狂开裂,变小变圆,触发全脑氧化;超过临界点,推高死亡风险,且损伤不可逆
本文作者:木白,转载于微信公众号:梅斯医学(ID:MedSci_cn),转载引用请注明原出处