
“早上困,中午困,下午困,晚上一拿手机就不困”“熬最长的夜,敷最贵的面膜”“三点睡五点起,阎王夸我好身体”......成了不少年轻人/打工人的真实写照。睡眠的重要性不言而喻,但随着社会飞速发展以及生活节奏加快,“拼命十三郎”们只能舍弃睡眠时间,转而投入996甚至007的“社畜”工作中。
除了繁忙的工作压缩了睡眠时间外,一个更常见的现象是“报复性熬夜”——白天被各种琐事儿缠身,只有当晚上躺在床上的那一刻,时间才开始属于自己,接着就是“无止境”的熬夜。当从手机中“缓过神”的时候,发现自己根本睡不了几个小时又要搬砖了!
今年最新发布的《2024中国居民睡眠健康白皮书》显示,我国居民的平均睡眠时长为6.75小时,甚至有28%的人夜间睡眠时长不足6小时。睡不着、睡不深、睡不够等问题困扰着越来越多的人。
正如大家调侃得那样“晚上不睡,白天崩溃”,崩溃的不仅是精神,还有身体的方方面面——熬夜使得主要心血管不良事件的风险提升92%;增加海马体中抑制神经元活动,破坏记忆巩固;导致癌症的发生等等。早在2007年,国际癌症研究机构(IARC)就把熬夜(包括昼夜节律打乱的轮班工作)定义为2A类致癌物。
近日,来自大连医科大学的研究团队揭示了睡眠不足成为癌症“铺路石”的详细机制——具体来说,当机体睡眠不足时,脂肪酸氧化能够感知到昼夜节律的紊乱,并进一步传递到致癌代谢信号,增强癌症干性和肿瘤发生。但好消息是,有改善方法!

DOI: 10.1016/j.cmet.2024.04.018
“睡眠不足会扰乱昼夜节律”并不是新闻,睡眠不足(SD)会引发多种病理过程,包括:免疫功能紊乱、新陈代谢失调,以及过早死亡。而这种昼夜节律的紊乱同样会作用于癌症发展过程,比如:改变葡萄糖、谷氨酸、胆汁酸和脂质代谢等诸多代谢,进而刺激肿瘤生长、转移和免疫逃逸。但其中的具体机制仍不清楚,也是本次研究的焦点。
第一步,研究者定位到生物机体内感知昼夜节律的关键一环——脂肪酸氧化(FAO)。
具体来说,研究者首先发现,与对照组小鼠相比,SD组有着更长的清醒时间,以及更短的非快速动眼(NREM)和快速动眼(REM)睡眠。由此可见,睡眠不足确实会导致小鼠昼夜节律发生紊乱。
紧接着,研究者分析了野生型C57BL/6J小鼠在SD和对照组培养4周后肺组织中的转录组和代谢组的差异。RNA测序结果显示,3284个基因在SD之后失去了昼夜振荡,而这些基因与脂质代谢的生物过程高度相关,尤其是FAO。
FAO是指,利用脂肪酸转化成的乙酰辅酶A(CoA)亚基来进一步生成烟酰胺腺嘌呤二核苷酸(NADH)、乙酰-CoA和三磷酸腺苷(ATP),参与到产生能量、氧化还原平衡和生物合成反应的过程中。事实上,与FAO相关的代谢酶和代谢物表现出生物节律,以维持生理功能的平衡。
对比SD组和对照组发现,对照组的FAO基因显示出节律模式,但SD组的FAO基因则出现了明显的紊乱。同时,进一步的超高效液相色谱/质谱分析显示,SD小鼠肺组织中振荡脂质代谢物的数量明显减少,并找到了47种节律紊乱的脂质代谢物,其中游离脂肪酸(FFAs)占比最大。
由此可见,FAO能在基因表达和代谢功能水平上感知到SD诱导的生理状态节律紊乱。
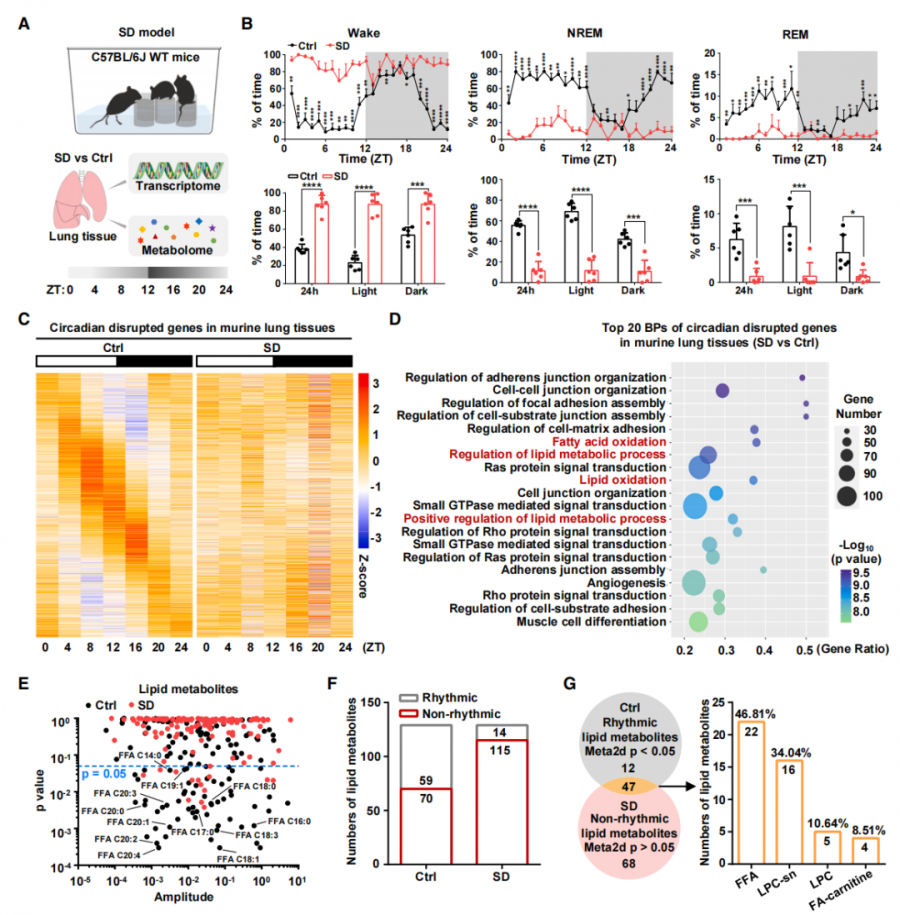
FAO能感知到SD情况下的昼夜节律紊乱
第二步,找到FAO在SD促癌过程中担任的“角色”。
与对照组对比,SD明显加速了肺癌的发生和发展,包括促进肺肿瘤的形成、提高Ki-67和CD166的蛋白水平,同时还会在mRNA和蛋白水平上增加MYC、SOX2、CD166和NANOG的表达。
类似的情况也发生在患者源性异种移植模型中,SD导致肿瘤体积明显增加,降低肿瘤小鼠的存活率,并提高了肿瘤组织中干性标记物的表达。
当研究者对肺肿瘤进行RNA-seq分析后发现,SD显著上调了827个基因,而这些上调的基因主要属于脂肪酸代谢过程,尤其是FAO。同时,SD组的肿瘤组织中FAO基因表达量明显高于对照组的,并表现出了节律紊乱。
为了进一步确认FAO在整个过程中的重要作用,研究者给小鼠注射了FAO抑制剂依托莫西(ETO)。结果并不令人意外,ETO逆转了SD增强的肿瘤发生,还阻碍了肺癌中Ki-67、CD166、乙酰-CoA和ATP水平的升高,即ETO逆转了SD增加的肿瘤形成率。
总结来说,FAO感知昼夜节律紊乱是SD增强肺癌干性的基础;相反,当FAO受到抑制,肿瘤进展也会被阻碍。

FAO昼夜节律紊乱维持SD诱导的肺肿瘤病变
第三步,详细定位到FAO节律紊乱维持SD诱导肺癌干性过程中的关键分子。
对比两组情况,研究者定位到13个可能导致SD引起的致癌FAO节律紊乱的常见基因。进一步,在这13个基因中发现,Acsl1 mRNA水平在SD处理的肺肿瘤中显著升高;类似的情况还出现在患者源性异种移植模型里,ACSL1蛋白表达同样有所增加。
那么,ACSL1是不是我们要找的关键分子呢?当研究者敲除了Ascl1之后,SD促进肺癌进展的作用被阻断了,Ki-67、CD166和ACSL1的表达也趋于平常,再一次证实了ACSL1是SD增强肺肿瘤发生和发展的必要条件。
于是,研究者进一步的分析了“可能作为ACSL1底物和产物的长链FAO代谢物”。鉴于棕榈酸(PA)是最主要的饱和脂肪酸,也是长链饱和或不饱和脂肪酸的前体,研究者将目光投向了PA及其代谢产物PA-CoA。
ACSL1具有将PA转化为PA-CoA的能力,而PA-CoA将以棕榈酰肉碱的形式进一步转运到线粒体中,以促进FAO的过程。而本实验结果表明,睡眠不足会扰乱了ACSL1的节律使得更多的PA转化为PA-CoA,从而促进FAO,导致肺癌生长的加速和干性特征的维持。
除此之外,ACSL1还能感知到SD诱导的CLOCK节律失常,同样能促进肺癌的发生。
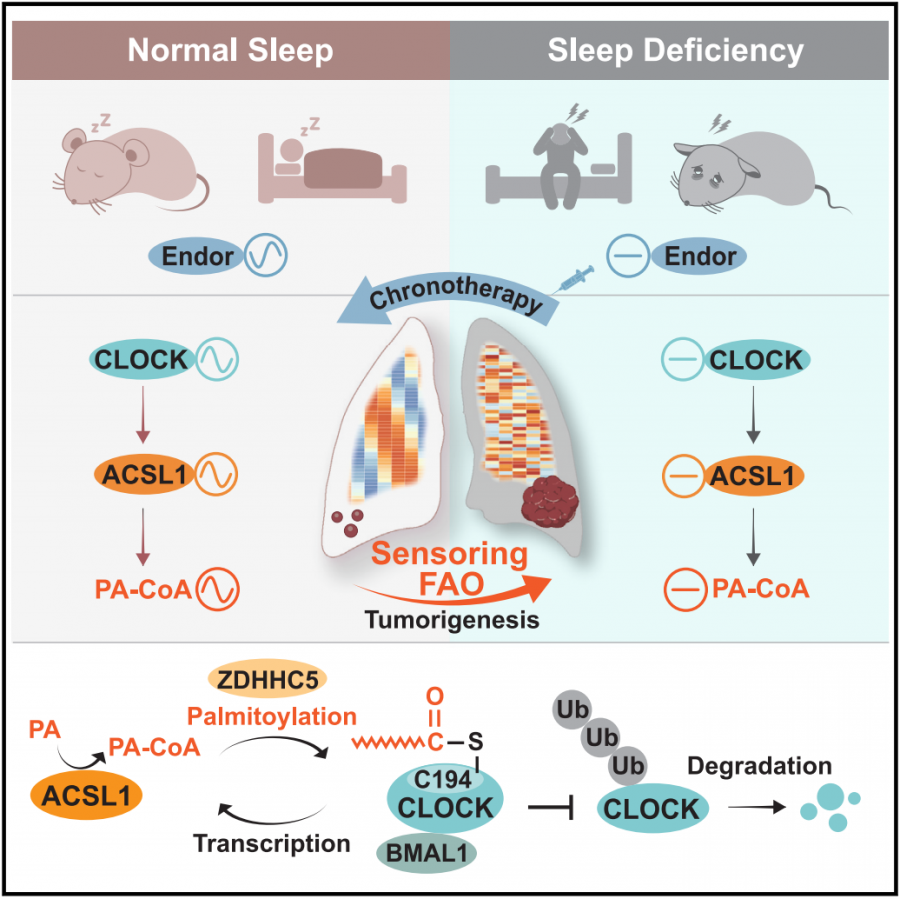
睡眠不足致癌的信号通路
当然,好消息是,研究者找到了解“癌”方案——β-内啡肽。
在14种与睡眠相关的激素中,研究者发现,注射了β-内啡肽能够显著下调肺癌细胞系中的CLOCK和ACSL1 mRNA的表达,而连续给药甚至能逆转SD诱导的肿瘤生长。
为了评估上述发现的临床价值,他们还开展了前瞻性和回顾性的临床研究,评估了血清β-内啡肽水平、睡眠质量与肺癌发展之间的临床相关性。结果令人“鼓舞”,血清β-内啡肽水平与深度睡眠和REM的比例呈正相关,而与清醒次数呈负相关,即β-内啡肽水平能够很好地预测睡眠质量。
不仅如此,对62例肺癌患者开展的回顾性分析显示,β-内啡肽水平与CLOCK、ACSL1、CD166和Ki-67评分呈负相关,呈现出抗肿瘤效果;而生存期分析结果表明,血清中的高β-内啡肽水平具有较好的预后价值。
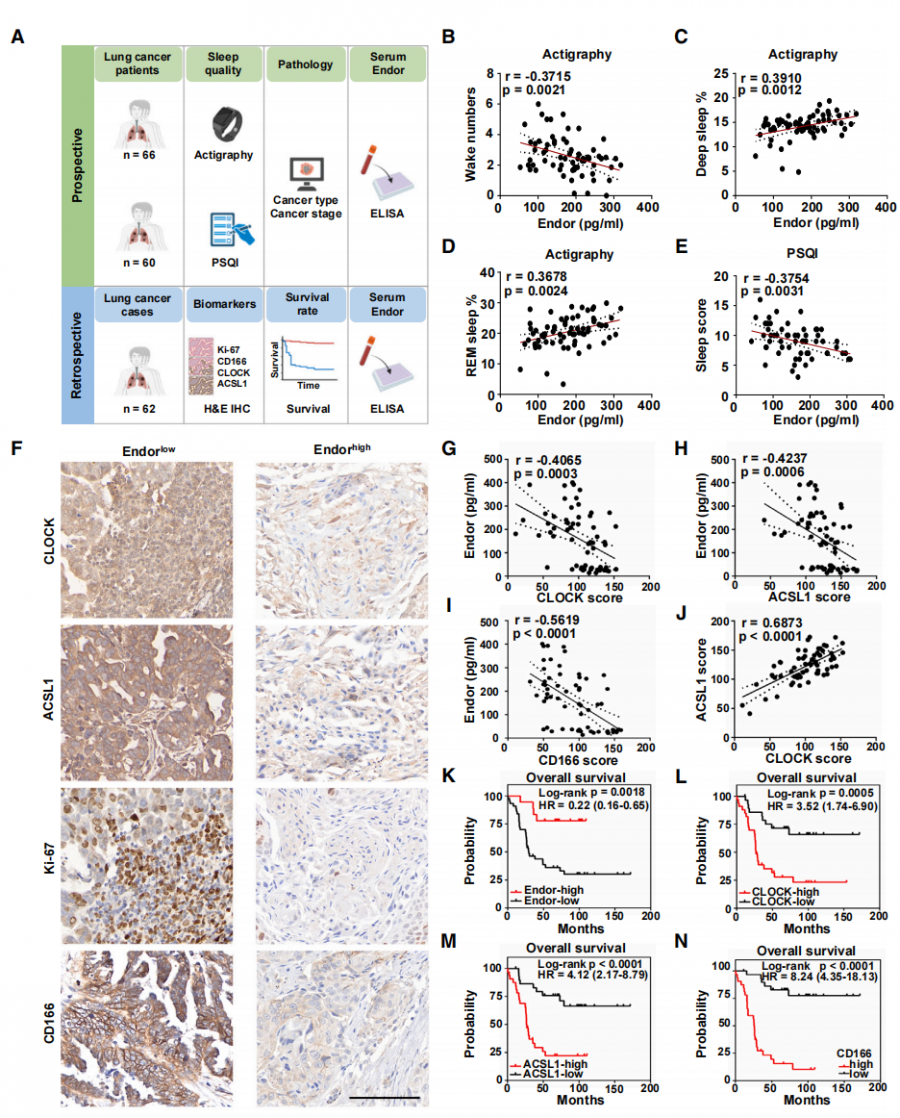
临床试验中β-内啡肽水平与指标之间的影响
综上所述,睡眠不足会促进癌症的生长、转移和免疫逃逸,而在这个过程中,FAO的节律紊乱发挥了重要的作用。不过好消息是,补充β-内啡肽或能有效地规避这一风险。
因此,“睡眠不足,癌症来找”是有科学依据的。睡眠的重要性不言而喻,不如就从今天开始早睡计划吧!
参考资料:
[1]Peng F, Lu J, Su K, Liu X, Luo H, He B, Wang C, Zhang X, An F, Lv D, Luo Y, Su Q, Jiang T, Deng Z, He B, Xu L, Guo T, Xiang J, Gu C, Wang L, Xu G, Xu Y, Li M, Kelley KW, Cui B, Liu Q. Oncogenic fatty acid oxidation senses circadian disruption in sleep-deficiency-enhanced tumorigenesis. Cell Metab. 2024 May 14:S1550-4131(24)00138-4. doi: 10.1016/j.cmet.2024.04.018. Epub ahead of print. PMID: 38772364.
原标题:熬夜熬得久,癌症找上门!国人学者发现:睡眠不足会促进肿瘤的发生,但补充这一物质可逆转
本文作者:Swagpp,转载于微信公众号:梅斯医学(ID:MedSci_cn),转载引用请注明原出处